Introdução
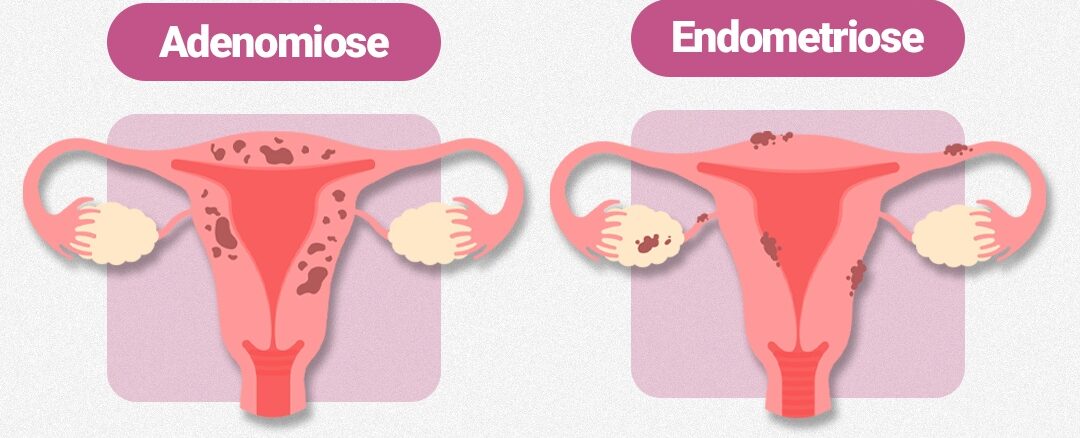
A endometriose é uma doença inflamatória crônica e complexa, caracterizada pela presença de tecido semelhante ao endométrio fora da cavidade uterina. Ela afeta cerca de 10% das mulheres em idade reprodutiva e pode causar dor pélvica intensa, dismenorreia, dispareunia e infertilidade.
Nos últimos anos, a atenção científica tem se voltado para o sistema endocanabinoide (ECS) — uma rede biológica fundamental para o controle da dor, da inflamação e da homeostase tecidual.
Estudos crescentes mostram que há uma disfunção do ECS na endometriose, o que pode contribuir para a fisiopatologia da doença e abrir caminhos terapêuticos com o uso de canabinoides exógenos (como CBD e THC).
Este artigo explora em profundidade as alterações do ECS na endometriose, a base mecanística dessa relação e as implicações clínicas para o uso da cannabis medicinal.
1. O que é o Sistema Endocanabinoide (ECS)?
O ECS é um sistema fisiológico complexo, composto por:
- Endocanabinoides: moléculas endógenas semelhantes aos fitocanabinoides da cannabis, como anandamida (AEA) e 2-araquidonoilglicerol (2-AG);
- Receptores canabinoides: principalmente CB₁ (predominante no sistema nervoso central) e CB₂ (em células imunes e tecidos periféricos);
- Enzimas metabólicas: responsáveis pela síntese e degradação (FAAH e MAGL);
- Função principal: manter o equilíbrio (homeostase) em diversos sistemas fisiológicos — dor, imunidade, inflamação, reprodução e humor.
Na endometriose, cada um desses componentes pode estar alterado, gerando um desequilíbrio que contribui para a persistência da inflamação e da dor crônica.
2. Evidências de Disfunção Endocanabinoide na Endometriose
2.1. Alterações na Expressão dos Receptores CB₁ e CB₂
Estudos histológicos e moleculares demonstram:
- Diminuição da expressão de CB₁ e CB₂ em lesões endometrióticas comparadas ao endométrio eutópico.
- Em contrapartida, receptores CB₁ aumentados em fibras nervosas pélvicas, o que pode estar relacionado à sensibilização dolorosa.
- Essa desregulação espacial do ECS cria um microambiente favorável à inflamação e à dor persistente.
📚 Referência: Dmitrieva et al., Fertility and Sterility, 2010; Sanchez et al., Journal of Clinical Medicine, 2022.
2.2. Níveis Alterados de Endocanabinoides
Estudos de fluido peritoneal e plasma mostram:
- Níveis reduzidos de anandamida (AEA) em pacientes com endometriose ativa;
- Diminuição de 2-AG associada a aumento da inflamação peritoneal;
- Alterações na atividade da FAAH (fatty acid amide hydrolase), enzima que degrada a AEA — excesso de FAAH → menos anandamida → menos regulação anti-inflamatória.
Essas descobertas reforçam a hipótese da chamada “deficiência endocanabinoide clínica”, proposta por Ethan Russo (2004), sugerindo que doenças crônicas de dor, como a endometriose, podem resultar de um tônus endocanabinoide baixo.
📚 Referência: Sanchez et al., Reproductive Sciences, 2021; Russo, Neuro Endocrinology Letters, 2004.
2.3. Correlação com Sintomas Clínicos
Estudos observacionais relacionam a disfunção do ECS a:
- Maior intensidade de dor pélvica;
- Piora da dismenorreia;
- Alterações na sensibilidade visceral e maior hiperalgesia central.
Em resumo, quanto menor o tônus endocanabinoide, maior a dor e pior o controle inflamatório.
📚 Referência: McAllister et al., Pain Medicine, 2020.
3. Como os Canabinoides Podem Restaurar o Equilíbrio
3.1. THC (Δ⁹-tetraidrocanabinol)
- Atua como agonista parcial de CB₁ e CB₂;
- Pode reduzir a liberação de neurotransmissores excitadores e modular vias nociceptivas;
- Efeitos anti-inflamatórios e antiangiogênicos indiretos;
- Potencial de alívio rápido da dor, mas com efeitos psicoativos dose-dependentes.
📚 Referência: Sugiura et al., Journal of Pharmacology and Experimental Therapeutics, 2018.
3.2. CBD (Canabidiol)
- Não psicoativo; modula receptores TRPV1, PPARγ, 5-HT₁A;
- Inibe a FAAH → aumenta os níveis de anandamida, restaurando o tônus endocanabinoide;
- Reduz citocinas pró-inflamatórias (IL-1β, TNF-α);
- Efeitos antiangiogênicos e antiproliferativos observados em cultura de células endometrióticas.
📚 Referência: De Petrocellis et al., British Journal of Pharmacology, 2011.
3.3. Sinergia THC + CBD
Estudos pré-clínicos sugerem que a combinação equilibrada pode oferecer:
- Maior analgesia (via CB₁/CB₂ e TRPV1);
- Menos efeitos colaterais psicoativos;
- Melhor modulação do sono e ansiedade, importantes em dor crônica pélvica.
📚 Referência: Barcella et al., Journal of Pain Research, 2023.
4. Implicações Clínicas e Terapêuticas
- O reconhecimento da disfunção endocanabinoide fundamenta o uso racional da cannabis medicinal como terapia adjuvante;
- A reposição canabinoide exógena (CBD isolado ou combinado com THC) pode restaurar o equilíbrio funcional do ECS;
- Ensaios clínicos (ENDOCAN-1, ENDO-CAN1) estão testando essa hipótese com extratos ricos em CBD para dor pélvica.
📚 ClinicalTrials.gov: NCT06477406; ENDOCAN-1 Trial.
5. Limitações e Perspectivas Futuras
Ainda há lacunas a preencher:
- Quantificar biomarcadores endocanabinoides como preditores de resposta;
- Definir doses ideais e via de administração;
- Investigar segurança reprodutiva e fertilidade;
- Conduzir ensaios clínicos multicêntricos robustos.
A integração do ECS na prática ginecológica é promissora, mas exige mais dados clínicos de alta qualidade.
6. Conclusão
A disfunção do sistema endocanabinoide é um achado consistente em mulheres com endometriose e pode explicar, ao menos em parte, a persistência da inflamação, da angiogênese e da dor crônica.
A cannabis medicinal, ao modular o ECS, representa uma estratégia terapêutica mecanisticamente plausível e potencialmente eficaz — especialmente quando usada como adjuvante em pacientes refratárias às terapias convencionais.
Contudo, a indicação deve ser individualizada, médica e baseada em evidências, até que estudos clínicos mais robustos confirmem os benefícios observados em nível experimental.
Referências Principais
- Sanchez AM et al. Journal of Clinical Medicine, 2022.
- Dmitrieva N et al. Fertility and Sterility, 2010.
- Russo EB. Neuro Endocrinology Letters, 2004.
- De Petrocellis L et al. Br J Pharmacol, 2011.
- McAllister M et al. Pain Medicine, 2020.
- Barcella C et al. J Pain Res, 2023.
- ClinicalTrials.gov: NCT06477406 (ENDOCAN-1).