há forte plausibilidade biológica — amparada por múltiplos estudos pré-clínicos — de que modular o sistema endocanabinoide (ECS) pode atenuar a neuroinflamação, reequilibrar a ativação microglial/astroglial e reduzir processos tóxicos ligados a Aβ/tau. Estudos em modelos AppNL-G-F/APP/PS1/5xFAD mostram melhora de comportamento cognitivo e redução de marcadores inflamatórios quando CB₂ é estimulado ou quando enzimas catabólicas (p.ex. MAGL) são inibidas. Contudo, a tradução para humanos ainda não provou que canabinoides retardam a progressão patológica da DA; faltam ensaios clínicos controlados com biomarcadores e estudos de segurança em longo prazo. PMC+1
1. Por que focar em neuroinflamação e no ECS?
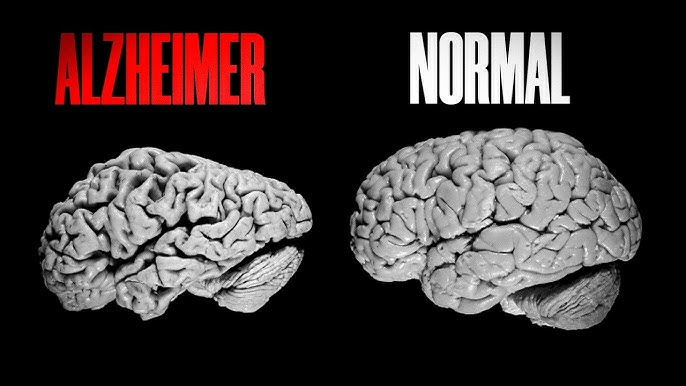
A neuroinflamação é hoje vista como um dos motores que alimentam a progressão da doença de Alzheimer (DA) — não apenas consequência da deposição de Aβ/tau, mas participante ativa da cascata patológica (ativação microglial crônica, liberação de citocinas pró-inflamatórias, estresse oxidativo, perda sináptica). O ECS (endocanabinoides — anandamida, 2-AG; receptores CB₁ e CB₂; enzimas FAAH e MAGL) regula neurotransmissão, plasticidade sináptica, respostas imunes e homeostase neurovascular. Alterações do ECS foram documentadas em tecido humano e em modelos animais de Alzheimer, tornando o sistema um alvo lógico para modular a neuroinflamação. PMC
2. Componentes do ECS relevantes para Alzheimer — resumo funcional
- CB₁ (CNR1): altamente expressa em neurónios; modula liberação de glutamato/GABA, influencia excitotoxicidade e plasticidade sináptica.
- CB₂ (CNR2): expressão baixa em cérebro saudável, mas é up-regulated em microglia ativada na DA (observado em áreas como o precuneus) e associada a fenótipos microgliais responsivos. Estimular CB₂ parece promover um fenótipo microglial mais “resolutivo” (anti-inflamatório/fagocítico) em modelos experimentais. Nature+1
- Enzimas catabólicas (MAGL, FAAH): degradam 2-AG e anandamida respectivamente. Inibir MAGL aumenta 2-AG e reduz derivados pró-inflamatórios (ácido araquidônico → prostaglandinas), uma via que tem mostrado efeito anti-inflamatório em rodentes. PMC+1
3. Mecanismos moleculares plausíveis — detalhe técnico
3.1 Modulação microglial via CB₂
Microglia é o “centro” da neuroinflamação na DA. A ativação persistente da microglia leva à produção de IL-1β, TNF-α, IL-6 e espécies reativas que danificam neurónios. Estudos recentes demonstram que a estimulação sustentada de CB₂ em microglia isola-das do fenótipo pró-inflamatório, reduz a produção de citocinas e aumenta marcadores e comportamentos relacionados à resolução/internação de resíduos (p.ex. maior fagocitose de Aβ em determinados paradigmas). Em modelos AppNL-G-F, estimulação de CB₂ controlou também a ativação astrocitária e traduziu-se em melhora dos testes cognitivos. Esses dados sugerem que CB₂ não só “suprime” inflamação, mas a ressignifica para um perfil reparador. Nature+1
3.2 Redução de mediadores pró-inflamatórios por inibição de MAGL
MAGL converte 2-AG (endocanabinoide com ações neuroprotetoras) em ácido araquidônico (AA) — precursor de prostaglandinas pró-inflamatórias. Inibidores de MAGL (p.ex. JZL184 em modelos) diminuem AA e prostaglandinas, reduzindo astrogliosis, citocinas inflamatórias e, em alguns modelos, fosforilação de tau e marcadores de morte neuronal. Esse mecanismo é atraente porque preserva os níveis de 2-AG ao mesmo tempo em que corta a via prostaglandínica pró-inflamatória. BioMed Central+1
3.3 Efeitos diretos e indiretos sobre Aβ e tau
Diferentes canabinoides (THC, CBD, endocanabinoides aumentado por inibição de MAGL) demonstraram, in vitro e em animais, diminuição da agregação de Aβ e redução da fosforilação de tau por rotas variadas: ativação de receptores canabinoides, modulação de PPARγ (implicado na regulação da inflamação e do metabolismo proteico), ação antioxidante direta e inibição de vias pró-apoptóticas. CBD, por exemplo, mostrou reduzir agregação de tau in vitro e atenuar apoptose induzida por Aβ via múltiplos caminhos moleculares. PMC+1
3.4 Restauração da sinalização sináptica
CB₁ regula liberação de neurotransmissores; sua modulação pode diminuir liberações glutamatérgicas excessivas e, assim, proteger contra excitotoxicidade. Em modelos transgênicos, tratamentos que modulam o ECS preservaram densidade sináptica e melhoraram desempenho em tarefas de memória espacial. PMC
4. Sumário da evidência pré-clínica (modelos e achados-chave)
- Modelos transgênicos (APP/PS1, 5xFAD, AppNL-G-F): tratamento crônico com agonistas CB₂, CBD, inibidores de MAGL ou preparações ricas em canabinoides frequentemente resultou em: redução de ativação microglial e marcadores inflamatórios, menor carga de Aβ em alguns estudos, redução de tau fosforilado, conservação sináptica e melhora em testes comportamentais de memória. Há uma convergência razoável entre laboratórios, apesar de heterogeneidade metodológica. PMC+1
- Estudos mecanísticos in vitro: CBD inibe agregação de tau e protege neurónios contra toxicidade Aβ; MAGL inhibitors reduzem prostaglandinas pró-inflamatórias; CB₂ agonists reprogramam microglia para fenótipo anti-inflamatório/fagocítico. PMC+1
Limitação crítica dos dados pré-clínicos: dose/tempo/roda—espécie e farmacocinética em roedores não traduzem diretamente para humanos (diferenças na expressão de receptores, barreira hematoencefálica, metabolismo). Resultados promissores em camundongo são um requisito, mas não garantia de eficácia clínica.
5. Lacunas de tradução e problemas de segurança a ter em conta
- Engajamento do alvo em humanos: precisamos de provas de que um agonista CB₂ ou inibidor MAGL altera efetivamente microglia/astrocitos humanos no cérebro do paciente com DA (target engagement). PET para CB₂/TSPO e biomarcadores no LCR/sangue são essenciais. Existem radiotraçadores CB₂ (p.ex. [¹¹C]NE40) testados em humanos, mas com sensibilidade/interpretabilidade ainda em desenvolvimento. PMC+1
- Segurança de estratégias enzimáticas: inibição de FAAH (aumenta anandamida) teve um evento clínico grave (BIA 10-2474) com lesões neurológicas em fase I — lembrete de que manipular enzimas do ECS pode ter efeitos off-target ou farmacodinâmicas imprevisíveis; protocolos de segurança rigorosos são obrigatórios. New England Journal of Medicine+1
- Psicoatividade do THC: compostos com atividade sobre CB₁ (THC) podem induzir sedação, prejuízo cognitivo agudo, risco de quedas e sintomas psiquiátricos — sobretudo relevantes em idosos com fragilidade e polifarmácia. Alternativas centradas em CB₂, MAGL ou CBD (com baixo/no THC) são biologicamente mais atraentes para efeitos anti-inflamatórios sem psicoatividade. PMC
- Heterogeneidade de formulações e qualidade farmacêutica: muitos estudos pré-clínicos usam compostos puros; produtos comerciais/fitoterápicos variam de qualidade, concentração e excipientes — isso dificulta replicabilidade clínica e regulações.
- Interações medicamentosas: canabinoides e inibidores enzimáticos interagem com CYPs e transportadores (importante em geriatria, polifarmácia).
6. Como avançar — prioridades experimentais e de ensaio clínico
Para mover do “promissor” ao “provado”, proponho conjunto mínimo de requisitos para estudos translacionais/ensaios clínicos:
a) Ensaios de prova de mecanismo (phase Ib/IIa) com biomarcadores:
- Desenho: RCT randomizado, duplo-cego, com braço placebo; curta duração inicial (12–16 semanas) para segurança e biomarcadores, seguido de extensão aberta.
- Endpoints biológicos (primary/secondary): PET-TSPO (microglial activation) e/ou PET-CB₂ (se disponível e validado), PET-Aβ e PET-tau (se aplicável), LCR (Aβ42/40, p-tau217/181, NfL), marcadores inflamatórios no LCR e plasma (IL-1β, TNF-α, IL-6), medidas de 2-AG/anandamida no LCR/plasma para provar aumento de endocanabinoides (target engagement). Cognitivo/comportamental como endpoints exploratórios (ADAS-Cog, CMAI). PMC+1
b) Seleção de fármacos/strategias com melhor razão risco/benefício para humanos:
- Preferir agonistas CB₂ seletivos, inibidores de MAGL com perfil de segurança humano já caracterizado, e CBD (por seu perfil não-psicoativo e múltiplos mecanismos). Evitar estratégias invasivas em FAAH sem dados de segurança robustos (lições do BIA 10-2474). BioMed Central+1
c) População de estudo e estratificação:
- Incluir pacientes com DA em estágios leves-moderados; estratificar por presença de inflamação elevada (p.ex. marcador TSPO elevado ou perfil inflamatório no sangue/CSF) pois estes podem ser os que mais beneficiam. Avaliar com cautela pacientes com história de psicose. PMC
d) Duração e follow-up:
- Estudos de biomarcador inicial (3–6 meses) e estudos de eficácia de doença (18–24 meses) para avaliar alterações em PET Aβ/tau e desfechos cognitivos primários. Ensaios longos são necessários para entender se há efeito modificador de doença.
e) Segurança:
- Monitorização rigorosa de sedação, quedas, interações medicamentosas (CYP), parâmetros cardiovasculares e eventuais sinais neurológicos atípicos. Documentar tolerância e dependência.
7. Considerações práticas para clínicos e investigadores
- Estado atual: há forte justificação científica para testar abordagens do ECS contra neuroinflamação em DA; porém ainda não há evidência clínica convincente de efeito modificador de doença. A utilização clínica de canabinoides (p.ex. dronabinol/nabilone) tem sido focada em sintomatologia neuropsiquiátrica (agitação) e não em modificação da patologia. PMC+1
- Pesquisas recomendadas: estudos translacionais com PET/CSF, RCTs com biomarcadores primários, comparações entre estratégias (CB₂ agonistas vs MAGL inhibitors vs CBD), e desenvolvimento de radiotraçadores CB₂/TSPO robustos. PMC+1
- Alerta de segurança: manipular enzimas do ECS (FAAH/MAGL) exige cautela — embora MAGL inibidores tenham mostrado resultados promissores em modelos, a história da FAAH (BIA 10-2474) demonstra risco potencialmente grave quando a farmacologia humana diverge do preditor animal. Rigorous dose-escalation e monitorização em Fase I são obrigatórias. New England Journal of Medicine+1
8. Conclusão concisa
A modulação do ECS é uma estratégia biologicamente plausível e bem fundamentada para atacar a neuroinflamação, um dos eixos centrais da fisiopatologia da DA. Dados pré-clínicos convergentes (CB₂, MAGL, CBD) mostram redução de inflamação, efeitos protetores sobre Aβ/tau e benefícios comportamentais em modelos animais. Todavia, o salto para a prática clínica exige evidência de target engagement em humanos, provas com biomarcadores de que a intervenção modifica a biologia da doença e estudos de segurança/eficácia de longo prazo. Até lá, canabinoides permanecem um campo promissor de investigação, não uma terapia modificadora de doença comprovada. Nature+1
Referências selecionadas (para leitura rápida)
- Li S, et al. Impact of the Cannabinoid System in Alzheimer’s Disease (review, 2023). PMC
- Sobue A., et al. Microglial cannabinoid receptor type II stimulation improves cognitive dysfunction in AppNL-G-F mice. (2024). Nature
- Herrmann N., et al. Randomized Placebo-Controlled Trial of Nabilone for Agitation in Alzheimer’s Disease. Am J Geriatr Psychiatry. 2019. PubMed
- Alali S., et al. Cannabidiol Inhibits Tau Aggregation In Vitro. (2021). PMC
- Pihlaja R., et al. MAGL inhibition and neuroinflammation (JZL184 and related studies). J Neuroinflammation, 2015; e outros trabalhos sobre MAGL/2-AG. BioMed Central+1
- NEJM / relatórios sobre o episódio clínico com o inibidor de FAAH BIA 10-2474 — lição de segurança translacional. New England Journal of Medicine+1
- Revisões sobre CBD e neuroproteção: Xiong et al. 2021; Bhunia et al. 2022. PMC+1
- Radiotraçadores CB₂ (p.ex. [¹¹C]NE40) — trabalho pré-clínico e estudos iniciais em humanos. PMC+1